Cosa sono i gliomi a basso grado di malignità?
I gliomi rappresentano circa il 30% dei tumori cerebrali e sono il tipo più frequente di tumori cerebrali intrinseci primitivi. Vengono distinti in gliomi a basso grado di malignità e ad alto grado di malignità.
I gliomi a basso grado di malignità sono tumori che vengono generalmente diagnosticati nel giovane adulto, coinvolgono principalmente una fascia di eta’ tra i 18 e 50 anni. Si caratterizzano per una crescita inizialmente proliferante compatta e poi diffusiva lungo i fasci di fibre della sostanza bianca. L’intervento chirurgico precoce si configura oggi come il gold standard nella gestione di questa patologia. Una chirurgia precoce significa avere una maggiore probabilita’ di ottenere un risultato radicale.
La genesi dei gliomi maligni cerebrali viene attualmente attribuita alla proliferazione di cellule staminali mutate (cancer stem cell), che rappresentano l’elemento costitutivo proliferante della neoplasia, da cui generano e si differenziano le altre cellule di cui è costituito il tumore. Non si conoscono allo stato attuale le cause per cui si generano le glioma cancer stem cells.
Cosa significa parlare di “grado di malignità” nei gliomi a basso grado?
Questi tumori si caratterizzano per una velocità di crescita lenta all’inizio della storia clinica (circa 2-4 mm/anno nel massimo diametro apprezzabile nelle sequenze FLAIR in risonanza magnetica RM). Nonostante ciò nel corso della evoluzione naturale sono destinati ad andare incontro a trasformazione maligna, cioè di acquisire un comportamento più maligno trasformandosi in un tumore a maggiore grado di malignità e più rapida proliferazione. I fattori clinici che influenzano tale comportamento sono il volume della lesione (un volume di 10-15 ml è stato individuato come volume minimo critico), l’età del paziente (superiore a 40 anni), la velocità di crescita (apprezzata in RM seriate volumetriche FLAIR eseguite a tre mesi di distanza di circa 2-4 mm/anno nel diametro massimo).
Gli studi molecolari e genetici hanno dimostrato che le cellule tumorali vengono progressivamente arricchite di mutazioni genetiche e caratteristiche cellulari, che le rendono sempre più aggressive e a crescita veloce, in altre parole maligne. La recente nuova classificazione mondiale dei gliomi cerebrali (CNS WHO 2021) si basa su una classificazione genetica molecolare per stratificare il rischio di progressione maligna di un glioma inizialmente classificato come glioma a basso grado.
La diagnosi istologica, oggi, prevede lo studio di specifici profili molecolari, utili nel predire con maggior precisione la prognosi della neoplasia o la sua suscettibilità al trattamento chemioterapico. L’analisi molecolare generalmente fornisce informazioni riguardo la mutazione IDH1, la codelezione 1p19q, lo stato di metilazione di MGMT, l’espressione di ATRX. In questo gruppo di pazienti la diagnosi istologica e molecolare, insieme alla entità di resezione chirurgica (stabilita sulla base di una RM encefalo eseguita nel post operatorio), serve per la programmazione delle future terapie adiuvanti (radio e chemioterapia, radioterapia esclusiva, chemioterapia esclusiva).
Quali sono i suoi sintomi?
Come per tutte le malattie del sistema nervoso centrale, i sintomi iniziali possono essere molto diversi e ingannevoli. Le variabili che influenzano la sintomatologia sono soprattutto la sede, il volume e la velocità di crescita. Vedremo in seguito alcuni esempi di sedi del cervello in cui il tumore si sviluppa. Per quanto riguarda volume e velocità di sviluppo, nelle forme a crescita più rapida si può sviluppare un’aumento della pressione all’interno del cranio, cioè una sindrome da ipertensione endocranica. Il paziente può riferire cefalea, spesso mattutina e talvolta accompagnata a vomito. Le manifestazioni cliniche più frequenti negli astrocitomi a basso grado di malignità, fino ad un 80% dei casi, sono le crisi epilettiche, focali, con esperienze soggettive estremamente variabili nelle descrizioni dei pazienti, o generalizzate, cioè con perdita di coscienza. Altri sintomi, molto poco frequenti, sono: perdita di forza degli arti di un lato (emiparesi), cambiamenti del carattere, personalità, intelletto, memoria, umore e funzioni cognitive. Più raramente disturbi visivi, annebbiamento della vista e visione doppia.
Come si arriva alla diagnosi di glioma a basso grado?
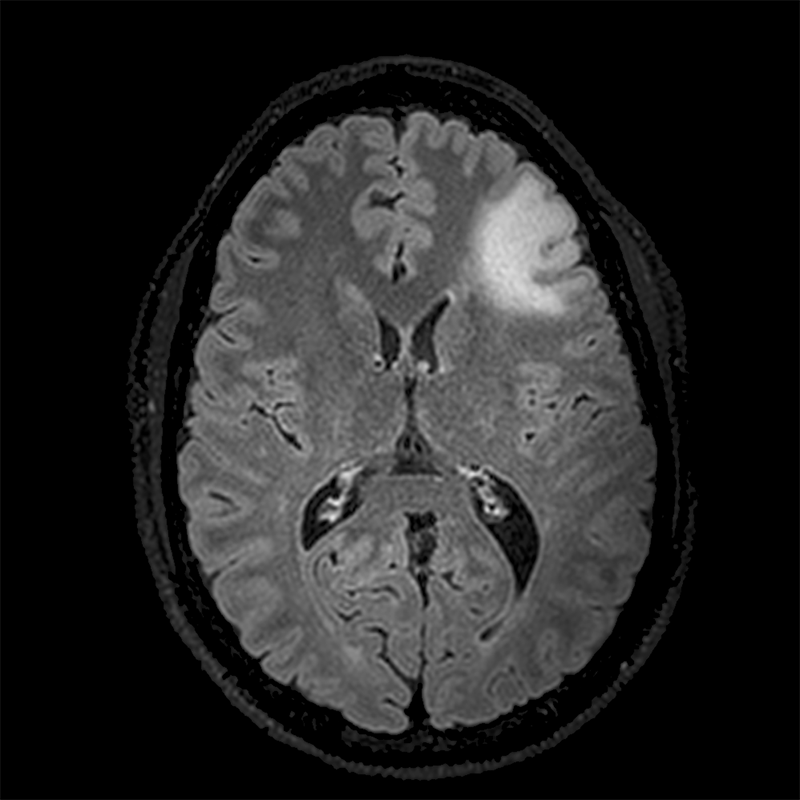
Nel sospetto di una malattia neurologica, ancora oggi molto spesso, come primo esame strumentale, si esegue la TAC cerebrale, che però è un’indagine insufficiente. L’esame strumentale principe è la RMN con mezzo di contrasto (Risonanza Magnetica Nucleare). Vengono forniti la sede, più frequentemente frontale e temporale, diversi dettagli anatomici utili al chirurgo e un’ipotesi di natura istologica in base al tipo di segnale di risonanza. In base alla captazione del mezzo di contrasto e alle caratteristiche della lesione, è possibile farsi un’idea preliminare, seppur grossolana, di tipo istologico o grado della lesione. Fino a pochi anni or sono l’assenza di captazione di mezzo di contrasto era quasi sinonimo di bassa malignità. Purtroppo oggi sappiamo che ciò non è vero ed anche lesioni apparentemente a basso grado, per la totale assenza di presa di contrasto, possono nascondere gruppi di cellule ad alto grado.
Esistono età più colpite da questa malattia? Esistono fattori di rischio?
Se osserviamo i pazienti portatori di glioma a basso grado, constatiamo che le età più interessate sono quelle del giovane adulto, in pieno benessere ed autonomia. I picchi maggiori sono tra i 25-30 e 50-55 anni. Tale distribuzione epidemiologica pone problemi rilevanti di ordine medico e sanitario in quanto si tratta di pazienti giovani, attivi, con famiglia spesso molto collaborante al seguito, ai quali riteniamo si debbano offrire tutti i percorsi terapeutici disponibili. Per quanto riguarda i fattori di rischio causale, come per esempio quelli ambientali legati alle abitudini voluttuarie, o all’alimentazione o ad altri fattori, per i tumori cerebrali non sono stati identificati specifici fattori di rischio.
Cosa fare di fronte ad un apparentemente a basso grado di malignità? Quali trattamenti sono oggi possibili e qual è l’iter diagnostico-terapeutico nel tempo?
Nonostante l’assenza a livello internazionale di Linee Guida gestionali per questa patologia, vi sono ormai delle livelli di evidenza accettati e condivisi, secondo le quali la maggior sopravvivenza si può ottenere mediante un trattamento multidisciplinare, che vede come primo passo la resezione chirurgica massimale. Il primo problema è quello della “massa tumorale iniziale”, al momento della prima diagnosi. Il paziente ha una risonanza che documenta una lesione più o meno voluminosa, in una determinata sede del cervello spesso funzionalmente importante, con caratteristiche riconducibili ad un glioma verosimilmente a basso grado di malignità. Il primo atto terapeutico da praticare è la resezione chirurgica. Essa permette di asportare gran parte del tumore, in molti casi fino ad un’asportazione definita “macroscopicamente radicale”, cioè fino ai suoi limiti visibili in microchirurgia. Esistono forme “circoscritte”, che si lasciano asportare in modo agevole, senza grossa componente infiltrante e forme invece senza confini netti, ad atteggiamento infiltrante un tessuto cerebrale funzionante, non suscettibili di ampia asportazione, dove si impone una resezione parziale.. In effetti, la resezione deve tenere conto della presenza di aree cerebrali funzionalmente critiche, che non possono essere asportate indiscriminatamente. Oggi è noto che le funzioni cerebrali sono “distribuite” nel cervello in maniera oltremodo complessa e variabile anche da paziente a paziente, perciò per pianificare un intervento chirurgico per un glioma, l’anatomia non basta. E’ necessario conoscere prima e durante l’intervento l’assetto funzionale di quel cervello al fine di conservare la sua integrità. Inoltre e’ da chiarire che comunque, anche in presenza di una resezione “macroscopicamente radicale”, l’area di infiltrazione periferica resta, in aree del cervello dove il chirurgo non può spingersi. Questo è il quesito decisivo su cui deve incentrarsi la decisione finale sull’indicazione chirurgica che va chiarita e va condivisa con il paziente. La risposta al quesito è la disponibilità per il chirurgo di tecniche pre- ed intraoperatorie finalizzate alla conservazione funzionale, delle quali trattiamo in un capitolo seguente. Quindi il paziente subisce l’intervento chirurgico, che in una netta maggioranza di casi non ha conseguenze neurologiche irreversibili e complete. Talvolta si manifestano deficit neurologici postoperatori, che durano alcuni giorni poi tendono spontaneamente a migliorare. Mediante riabilitazione nel 90-95% dei casi il deficit viene completamente recuperato ed il paziente torna ad una normale vita di relazione. L’anatomo-patologo stila un referto istologico definitivo, sulla base del quale viene pianificata una eventuale terapia adiuvante postoperatoria. Se vi sono caratteristiche istologiche specifiche, il paziente deve affidarsi ad un centro di radio-chemioterapia. Questa fase della terapia può essere valutata anche in quelle forme nelle quali il chirurgo non ha potuto asportare tutta la lesione per l’atteggiamento infiltrante nel cervello, proprio in aree dove erano state individuate funzioni neurologiche importanti. In questi casi i residui post-chirurgici possono essere trattati con le terapie radianti e farmacologiche. Il paziente segue un programma di controlli RMN nel tempo, che permettono di verificare l’andamento della malattia, una recidiva o la ricrescita di un’eventuale residuo lasciato in sede obbligatoriamente dal chirurgo. Si possono valutare l’efficacia delle terapie radianti e chemioterapiche, constatare un’eventuale ripresa di malattia ed il suo grado di malignità, spesso maggiore di quello iniziale.
Quali sono le aree del cervello più frequentemente sede di glioma a basso grado?
Tutto il cervello può essere sede di un glioma a basso grado di malignità. Tuttavia, dall’esperienza accumulata negli anni nel nostro centro, possiamo schematizzare alcune aree del cervello, che sono più frequentemente interessate.
Area sensitivo-motoria
Sono aree deputate all’invio in periferia dello schema motorio pianificato dalle aree frontali e premotorie. Il movimento armonico, correttamente finalizzato ad un preciso scopo viene eseguito dai muscoli. Ma anche funzioni sensoriali, cioè di contatto con il mondo esterno e di informazione al cervello sulle sue caratteristiche specifiche.
Area premotoria
Si tratta di aree antistanti alle aree sensitivo-motorie ed hanno molte funzioni: cognitive, controllo dell’umore, controllo dei comportamenti e della vita di relazione, funzioni di pianificazione del movimento finalizzato e della sua adeguatezza nel tempo e nello spazio.
Area insulare
L’insula è un’area profonda immersa tra i lobi temporale e frontale. E’ implicata nel linguaggio, movimento volontario, funzioni vegetative come il controllo del cuore e dell’apparato cardiocircolatorio.
Area parieto-occipitale
Situata posteriormente alle aree sensitivo-motorie, presiede al controllo delle funzioni cognitive superiori ed associative, visive, di memoria e ha molte funzioni di controllo della coordinazione di tutti gli stimoli, emotivi e sensoriali, che arrivano al cervello.
Gliomi bassio grado in sede premotoria, motoria ed insulare. Considerazioni diagnostico-terapeutiche.
In considerazione della loro frequenza, criticità dell’area funzionale e complessità dell’intervento e del monitoraggio neurofisiologico intraoperatorio, descriviamo alcune sedi anatomiche meritevoli di considerazioni peculiari.
Gliomi premotori
Sono quelle forme che si accrescono in area frontale, prevalentemente sulla linea mediana. Nettamente prevalente l´esordio con crisi epilettiche, non manifestano praticamente mai deficit neurologici focali. Data la sede è indicata l´asportazione il più possibile radicale. La parte posteriore spesso interessa l´area motoria, pertanto è indicato un monitoraggio neurofisiologico intraoperatorio, se possibile, anche a paziente sveglio e collaborante. Dopo l´intervento non vi sono in genere sequele importanti. Una possibile manifestazione è quella detta “sindrome dell´area premotoria”, che comprende un apatia talora completa, mutismo e deficit di pianificazione dei movimenti degli arti controlaterali. In genere questi sintomi sono reversibili nell´arco di pochi giorni o alcune settimane.
Gliomi motori
Sono quelle forme che si sviluppano nell’area sensitivo-motoria. Quest’area del cervello purtroppo non può essere asportata o manipolata, in quanto sede della funzione di movimento degli arti controlaterali. In genere viene richiesto al paziente di partecipare durante l´intervento, fornendo informazioni soggettive di tipo motorio e sensoriale. Il problema di queste forme è la radicalità, che talvolta non può essere ottenuta per l’impossibilità di asportare parti del tumore compenetrate all´area motoria stessa.
Gliomi insulari
Si tratta di lesioni localizzate all’interno del cervello, in un’area detta “insula”, che abbiamo già descritto da un punto di vista funzionale e anatomico. Sono lesioni che richiedono un notevole impegno da parte del paziente e del chirurgo. Se il paziente è collaborante, l’intervento viene eseguito da sveglio, anche se è necessario dire che la durata può essere non trascurabile. Il reale rischio di questa chirurgia è di deficit di movimento degli arti, per un danno a carico delle vie motorie. In genere la rieducazione funzionale rende possibile un recupero dopo un variabile lasso di tempo.
Abbiamo parlato di aspetto funzionale. Quali sono le tecniche pre- ed intraoperatorie a disposizione? Cosa significano i termini “stimolazione cerebrale” e “mappaggio corticale”? Inoltre, cosa vuol dire “neurofisiologia intraoperatoria”
Tutti i pazienti vengono operati con l’ausilio del “neuronavigatore” e del “microscopio intraoperatorio”, strumenti routinari in ogni intervento per pianificare, dirigere e individuare i confini delle resezioni, nonché per conservare vasi sanguigni ed encefalo.
Nel soggetto portatore di glioma in area critica che deve affrontare un intervento, viene eseguita una fRMN (Risonanza Magnetica Nucleare funzionale), che documenta quali funzioni cerebrali sono presenti attorno o anche all’interno del tumore stesso. Questo esame, oggi standardizzato ed entrato nella routine quotidiana, fornisce informazioni funzionali molto utili e permette di descrivere al paziente un “livello di rischio chirurgico” inducendo anche ad eseguire, se necessario, un intervento a paziente sveglio. L’intervento con paziente sveglio e collaborante, permette di far eseguire al soggetto compiti intraoperatori (movimento degli arti, parola, sensibilità, memoria) che testimoniano l’integrità dell’area in cui il chirurgo sta intervenendo. Offre precocemente segnali di compromissione neurologica e impone al chirurgo di fermarsi se necessario. Tutto ciò in anestesia generale non sarebbe possibile e riteniamo che tale metodica sia oggi insostituibile nella chirurgia delle aree critiche.
In modo sistematico, sia in alcuni interventi in anestesia generale, che durante gli interventi a paziente sveglio, viene eseguita la stimolazione elettrica diretta dell’encefalo (DCS o DES: Direct Cortical Stimulation o Direct Electrical Stimulation). Il soggetto che sarà operato da sveglio viene istruito opportunamente ed avvertito del decorso dell’intervento e della stimolazione. Vengono effettuati preoperatoriamente test semplici, che verranno ripetuti in sala operatoria per la valutazione delle aree del linguaggio. La stimolazione prevede l’utilizzo di un apparecchio generatore di correnti elettriche tarate a valori di frequenza, intensità e tempo di applicazione adeguati per poter essere applicate al cervello, sia nel soggetto sveglio, che nel paziente in anestesia generale. Il generatore invia la corrente ad una sonda di forme opportune e dimensioni molto piccole, che viene tenuta dal chirurgo e usata per stimolare elettricamente il tessuto cerebrale. Questo permette di evocare risposte obiettive visibili e registrabili di vario tipo, che indicano che quella piccola area del cervello deve essere rispettata. In caso contrario il paziente avrà un deficit grave relativo a quella specifica funzione cerebrale. Nei pazienti con lesioni in area del linguaggio operati da svegli la DCS evidenzia aree critiche per l’espressione linguistica, per la comprensione e per la sua articolazione. Il paziente, mentre viene invitato a parlare sperimenta fenomeni volutamente indotti di interferenza della parola come impaccio, trascinamento della parola, incapacità di pronunciare parole o sillabe o ancora di riconoscere immagini, fino ad un blocco completo (speech-arrest o arresto del linguaggio), temporaneo, reversibile, della durata di pochi secondi.
Nel caso di tumori che si sviluppano in aree di competenza sensitivo-motoria della mano, braccio o arti inferiori, il soggetto sveglio avvertirà movimenti, scosse, formicolii (parestesie) e sensazioni di movimento. La DCS è molto selettiva è può essere effettuata anche nelle immediate vicinanze del cratere chirurgico senza nessuna interferenza.
Negli ultimi anni è stata sviluppata a Udine una tecnica complementare. In effetti la stimolazione elettrica agisce su un’area quasi puntiforme e funzioni più complesse possono no essere evocato mentre questo succede con funzioni più semplici come ad es. il movimento. Per tale motivo si è iniziato ad usare dei test neuropsicologici per valutare una funzione (cognitiva) più complessa. Questi test vengono somministrati con una determinata metodica in modo da avere un feedback continuo ed immediato sulle funzioni di un’area che non avrebbe invece risposto alla stimolazione diretta.
Il movimento dei segmenti degli arti viene cercato e ottenuto anche in anestesia generale stimolando le aree motorie. Durante la fase di stimolazione, preliminare all’asportazione del tumore, in sala è presente pressoché sistematicamente il neurofisiologo. Ha il compito importante di monitorare la fase di stimolazione mediante la registrazione corticografica, cioè un elettroencefalogramma intraoperatorio. E’ molto utile per riconoscere precocemente onde anomale, crisi epilettiche all’esordio e attività cerebrali patologiche, che indicano repentinamente al chirurgo che è necessario fermarsi perché potrebbe sopraggiungere una vera e propria crisi epilettica clinica, cioè un fenomeno improvviso, parossistico, percepibile dal paziente e dai presenti, che deve essere controllato e sedato, con la conseguente perdita della collaborazione del soggetto. Il neurofisiologo è anche di grande aiuto per il chirurgo nel controllo delle funzioni motorie e sensoriali, che richiedono l’integrità di specifiche vie nervose ed aree corticali, che diversamente non sarebbero individuabili.
Qual è la prognosi o in altre parole l’aspettativa di vita per un paziente affetto da glioma a basso grado di malignità? Possiamo fare considerazioni sull’aspetto qualitativo della vita dopo l’intervento?
I gliomi a basso grado di malignità non sono tumori benigni. Hanno un’intrinseca tendenza a ripresentarsi e a trasformarsi in varianti maligne, Si può ritenere che il 60-70% delle forme recidive abbiano un grado più elevato del 2° grado di partenza. Gli studi riportati recentemente in letteratura identificano nell’estensione di resezione chirurgica il predittore indipendente più importante in termini prognostici sia per la soppravvivenza globale che per il rischio di recidiva.
Gli altri fattori di rischio analizzati, come le condizioni cliniche di partenza o la sede anatomica del glioma, si sono rivelati meno importanti. In particolare, una giovane età all’esordio è correlata ad una maggiore probabilità di lunga sopravvivenza. Questo dato è indicativo di una storia biologica del tumore, come qualcosa che nel tempo si “altera” in modo progressivo, divenendo sempre istologicamente più “mutato”. Pertanto la resezione chirurgica, che permette una riduzione drastica della popolazione cellulare tumorale diventa determinante per la buona riuscita del risultato ed anche delle successive terapie radianti e farmacologiche. Tuttavia, esiste anche un altro aspetto importante, quello della qualità della vita del soggetto, inerente ai deficit che possono essere causati dalla crescita del tumore. Il tumore, se non viene operato, conduce in una maggioranza dei casi ed in un tempo variabile ad un peggioramento neurologico. Si possono manifestare crisi epilettiche e deficit neurologici ingravescenti. Questo giustifica ulteriormente la chirurgia, perché non esiste nessun altro provvedimento, che possa portare ad un miglioramento clinico neurologico altrettanto rapido. Tuttavia, l’intervento deve essere necessariamente effettuato con criteri e tecniche che offrano al paziente una elevata probabilità di uscire indenne dall’intervento che possibilmente dovrebbe essere macroscopicamente quanto più radicale tenendo conto delle funzioni da preservare o che perlomeno possano recuperare in tempi brevi. Riteniamo che questo obiettivo sia raggiungibile soltanto usando tecniche pre- ed intraoperatorie di localizzazione e conservazione funzionale, quali la fRMN, il paziente sveglio e collaborante, la stimolazione ed il mappaggio cerebrale e il monitoraggio neurofisiologico intraoperatorio. Va però detto che tutta la metodica non azzera il rischio di un deficit permanente.
Da un punto di vista pratico, come viene seguito un paziente con glioma a a basso grado di malignità dopo l’intervento chirurgico?
In tutti i nostri pazienti raccomandiamo una RMN cerebrale con mezzo di contrasto dopo 4/5 mesi dall’intervento. Questo esame documenta l’entità dell’asportazione e l’evoluzione del cavo chirurgico. Se non vi è ripresa di malattia e non vengono documentati residui tumorali, il paziente viene monitorato nel tempo con controlli di risonanza ogni 6-8 mesi. La cadenza delle RMN di controllo può variare in base al decorso clinico e alle caratteristiche delle immagini di risonanza. Vista anche la molteplicità dei fattori prognostici individuali non è possibile stabilire a priori dei criteri rigidi applicabili a tutti i pazienti. In base alla storia clinica del soggetto, alla RMN e al referto istologico, si prendono le decisioni più opportune sul trattamento delle recidive o dei residui.